La eficacia de las pruebas serológicas (rápida) en la detección del nuevo coronavirus (COVID-19) estuvo en tela de juicio desde que el Gobierno de Martín Vizcarra anunció la compra de 1.4 millones de estos insumos de descarte del virus a medidas de marzo último. Algunos expertos enfatizaron que la prueba rápida, en comparación a la llamada PCR o molecular, arroja un falso negativo, de tal manera que no se estaría detectando con celeridad si el paciente presenta o no el coronavirus.
La exministra de Salud Silvia Pessah explicó que este tipo de pruebas tiene como fin hallar dos tipos de anticuerpos: la Inmunoglobulina (IgG) e Inmunoglobulina M (Igm), que desarrolla el organismo infectado por el COVID-19. “Pero para que se produzca la Igm debes tener, por lo menos, entre cinco a siete días (de contraído el virus). Entonces, ¿(qué pasa con) todas esas personas que siguen contagiando, que no van a tener la IGM todavía, por ejemplo, los primeros tres días?”, planteó la exministra.
Los cuestionamientos a la prueba serológica volvieron sonar en la última semana, luego que el excongresista Glider Ushñahua falleció el jueves pasado en el Hospital de Essalud de Pucallpa, en la región Ucayali, por neumonía atípica a causa de COVID-19, tras haber dado negativo a la prueba rápida para coronavirus que le tomaron porque presentaba los síntomas de la enfermedad.
Consultado sobre el caso de Ushñahua, el ministro de Salud, Víctor Zamora, indicó que ya cuenta con el reporte que solicitó a raíz del fallecimiento del excongresista, el cual confirma que el servicio “no aplicó algunos protocolos". “No se aplicaron adecuadamente algunos protocolos. Este evento, así como otros que he ordenado realizar en otras circunstancias, nos permiten mejores servicios que estamos brindando”, afirmó este lunes en RPP.
En el Perú, el diagnóstico de COVID-19 se basó únicamente en la prueba de reacción en cadena de la polimerasa con transcriptasa reversa en tiempo real (RT-PCR o molecular) hasta fines de marzo del 2020 (aproximadamente 800 pruebas diarias); sin embargo, las pruebas serológicas rápidas pueden ser un apoyo al diagnóstico, tomando en cuenta la sencillez de su aplicación y que el resultado se obtiene en diez minutos. Sin embargo, se requiere evaluar el rendimiento de dichas pruebas en condiciones de campo, tal como sugiere el informe con los primeros resultados del Instituto Nacional de Salud (INS) del Perú sobre la evaluación de las pruebas serológicas o "rápidas".
La prueba molecular es útil en las tres primeras semanas de infección y es hoy el estándar de referencia recomendado por la OMS. No obstante, esta prueba tiene algunos inconvenientes, como su alto costo, la dificultad para implementarse en escenarios de recursos limitados, la sensibilidad variable dependiendo del tipo de muestra (93% en el lavado broncoalveolar, 72% en esputo, 63% en hisopado nasal y 32% en hisopado faríngeo) y su baja sensibilidad a partir de la tercera semana de iniciados los síntomas.
En el informe con los primeros resultados del Instituto Nacional de Salud (INS) del Perú sobre la evaluación de las pruebas serológicas o "rápidas" se revela que la mencionada prueba logró detectar un mayor número de casos respecto a la molecular, "sobre todo a partir de la segunda semana de inicio de síntomas. Además, presentó una alta especificidad. Los resultados mostrarían su utilidad como prueba complementaria a la prueba molecular, especialmente durante la segunda y tercera semana de enfermedad".
"Las pruebas inmunológicas pueden ser una ayuda diagnóstica complementaria y un apoyo importante en la vigilancia epidemiológica. Estas pruebas se basan en la detección de las inmunoglobulinas IgM e IgG contra SARS-CoV-2, las cuales aparecen a partir de la segunda semana de infección (5). Existen pruebas basadas en la detección de anticuerpos en sangre venosa y sangre capilar. Estas últimas denominadas «pruebas serológicas rápidas», que permiten obtener resultados en pocos minutos. Sin embargo, la sensibilidad parece ser dependiente del momento de toma de muestra y puede ser mayor al 90% a partir de la segunda semana de síntomas (6). Su uso podría contribuir de manera significativa al diagnóstico clínico, particularmente en pacientes hospitalizados, en quienes las pruebas moleculares hayan resultado negativas o no se hayan realizado (6)", se lee en el informe.
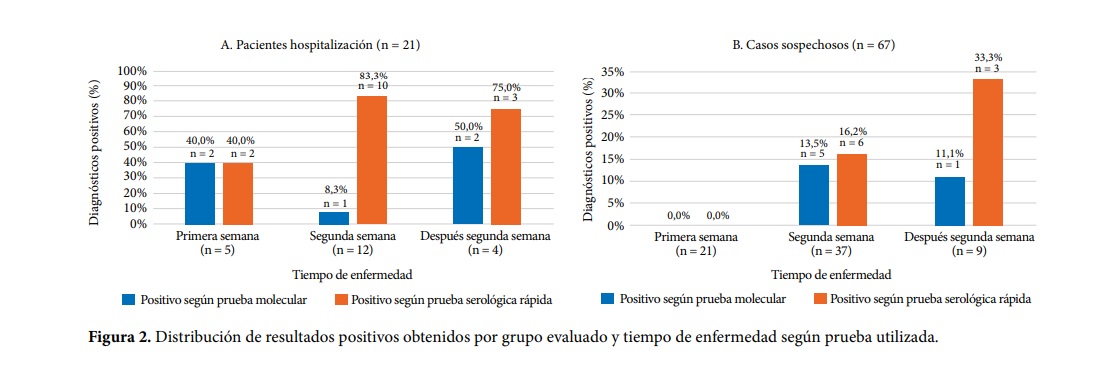
En la publicación Revista Peruana de Medicina Experimental y Salud Pública se indica que tras la comparación del rendimiento de la prueba molecular y de la prueba rápida (en 144 personas), se observó que esta última identificó 56,8% casos adicionales. En la estratificación por grupo de estudio, la prueba rápida detectó 61,9% y 38,1% de casos adicionales en pacientes hospitalizados y casos sospechosos visitados en el domicilio, respectivamente. Asimismo, cuando se tomó en cuenta el tiempo de la enfermedad, determinaron que se incrementa la cantidad de casos positivos conforme aumenta ese tiempo.
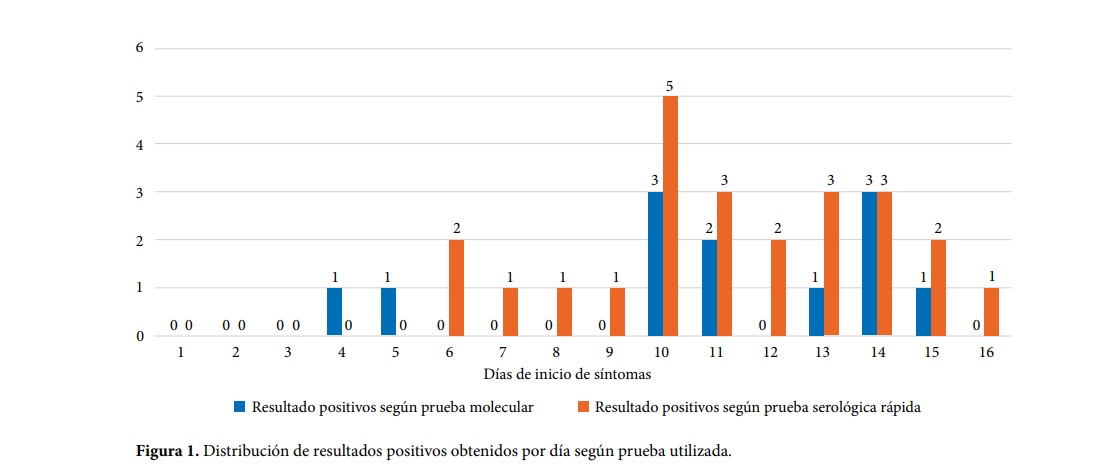
"El rendimiento diagnóstico de la prueba rápida fue superior a la prueba molecular a partir de la segunda semana de síntomas. Esto concuerda con lo reportado por Xie et al. quien encontró que la prueba rápida identificó cinco casos positivos que habían tenido un RT-PCR inicial negativo en pacientes hospitalizados con neumonía clínica y radiológicamente compatible con Covid-19 y con contactos positivos, y que finalmente tuvieron un RT-PCR positivo después de múltiples muestras", indica la publicación.
El estudio concluye, en otros aspectos, que la prueba molecular puede resultar negativa en una persona infectada con coronavirus en los siguientes escenarios: a) si la extracción de la muestra, manejo, transporte o almacenamiento de la misma no fue realizada de manera adecuada; b) si existe presencia de inhibidores del RT-PCR en la muestra de ARN extraídos; y c) si la cantidad de virus es insuficiente para ser detectada, lo cual ocurre en etapas muy tempranas o muy tardías de la infección. La carga viral es diferente dependiendo del estadio de la infección, de manera que cuando el sistema inmune produce los anticuerpos, el virus disminuye pudiendo no ser detectable por la prueba molecular.
El biólogo Ernesto Bustamante, exjefe del Instituto Nacional de Salud (INS), le dijo a La Mula que que el artículo del INS confirma que "definición de positivos de la prueba molecular y la prueba rápida es diferente", debido a que el positivo en la PCR es infectarte y contagiante, mientras en la serológica la persona con anticuerpos ya no puede contagiar. "En los primeros cinco días tras el contagio, el cuerpo todavía no ha generado anticuerpos, por lo que es imposible que la prueba rápida detecte la presencia del virus. Esos son los falsos negativos", indicó.
Bustamante, uno de los primeros críticos a la compra de pruebas serológicas, afirmó que una muestra de 144 personas en términos estadísticos es, biológicamente, poco significativo. "Para hacer este tipo de estudios la muestra debe ser mucho mayor a 144 personas, donde una no cumple la edad y no se tiene certeza del sexo de las personas", añadió el biólogo. Asimismo, cuestionó que en el artículo se tome como el inicio del proceso desde el primer día en que aparecen los síntomas y no desde que se produjo la infección por COVID-19.
César Cabezas, el actual jefe del Instituto Nacional de Salud (INS), aclaró que, la aplicación tanto de las pruebas moleculares como rápidas, tienen un "criterio clínico epidemiológico", por lo que cada una cumple una función diferente en diagnostico del COVID-19. "Si el virus está activo en el cuerpo, la prueba molecular lo va a detectar; sin embargo, la serológica puede obtener resultados cuando este ya se desactivó; y nos brinda información de donde se ha podido propagar", indicó Cabezas a La Mula.
En su cuenta de Twitter, el epidemiólogo y exministro de Salud, Anibal Velásquez, afirmó a finales de marzo que la pruebas rápidas miden la inmunidad, permitiendo que las personas inmunes al COVID-19 (incapaces de transmitir el virus) puedan salir de sus hogares y apuntalar la fuerza laboral. "Personal de salud inmune podría continuar trabajando. La creciente inmunidad en la comunidad terminara la epidemia", añadió.
Total respaldo a las pruebas rápidas
El ministro Víctor Zamora garantizó la eficacia de las pruebas rápidas que el Perú adquirió de China, luego de que el portal Ojo Público revelara que un lote que llegó al país a fines de marzo, tras la adquisición de la compañía biotecnológica china Orient Gene Biotech, no contaba con la certificación emitida por la Administración Nacional de Productos Médicos de este país.

Según Ojo Público, los kits comprados a esa empresa china no tenían el certificado para dispositivo médico otorgado por la Administración Nacional de Productos Médicos (NMPA) de dicho país. Sin embargo, Zamora aclaró este domingo que cuando se compró los 1.4 millones de pruebas rápidas la certificación sanitaria del país de origen no era un requisito de exportación.
“Nosotros hemos informado de que en el momento que se hizo la adquisición del 1.4 millones de pruebas rápidas era de que pudiesen cumplir con los requisitos estándares de la Unión Europa. Ese requisito se cumplió. Posterior a la ejecución de la compra hecha por el gobierno peruano y posterior a la recepción del primer lote, China estableció que sus productos de exportación tengan certificados que nosotros hemos requerido”, dijo.
Explicó que los nuevos lotes ya cumplen con los nuevos requisitos exigidos por la Administración Nacional de Productos Médicos de China (NMPA). “Está garantizada la eficacia de las pruebas. Cada lote, además de cumplir con la certificación, se cumple con la prueba de campo. […] La certificación exigida por los exportadores de China fue un requisito posterior a la compra del Perú”, afirmó el ministro de Salud, al reiterar que las pruebas serológicas son un complemento de las moleculares y no su reemplazo.
(Foto de cabecera: Andina)
Notas relacionadas:
Día 38: Minsa confirma 19,250 casos positivos y 530 fallecidos por Covid-19
Colegio Médico pide ampliar en el Perú la cuarentena por Covid-19 dos semanas más
Minsa tuvo que anular compra de mascarillas N-95 porque el proveedor no cumplió con plazos
Perú compró pruebas rápidas para Covid-19 sin certificación de autoridad china: ministro de Salud responde


